����
��ϸ��Ϣ���Ķ�����!������������˹��ͷ����������ݹ���Ա���ԣ�Ϊ���Ƽ����ݹ���Ա�������飬���ڿγ���������Ѷ���ע��˳��ͼ�����Ź��ںţ�asht2001��,�źţ���asht01) ��
�˹���ѯ—������˴���ѯ�������Կγ̡�
>>����ʡ��������22��1��-23��1��ʱ��
ˢ������—������˴�����ˢ��APP��
������ʡ��ͼ�顿>>23�����ʡ���̲�+����(6����)
������ʡ�����⡿>>�ز����ٵ�ʡ������23��+���
����(��ѡ��)���ʵĽṹ�������ʣ�������������Խǿ���۵�Խ�ߡ�һЩ��������۵����±���
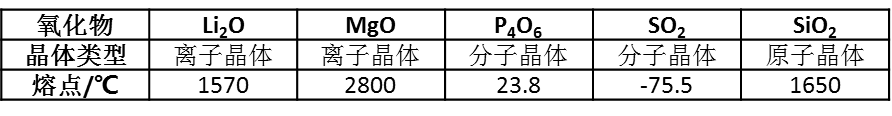
��������ѡ���У����ܽ����������۵���ڲ�����ǣ�
����A.���Ӿ����е�����������Խ����ķ��Ӽ�������
����B.���Ӿ����е�����������Խ�ǿ�����Ӽ�
����C.ԭ�Ӿ����е�����������Խ����Ĺ��ۼ�
����D.Li2O�е����Ӽ�����MgO��
��������
������һ����ȷ�����͡�
�������⿼�黯ѧ�е��۵㡣
�����ڶ���������ԭ����
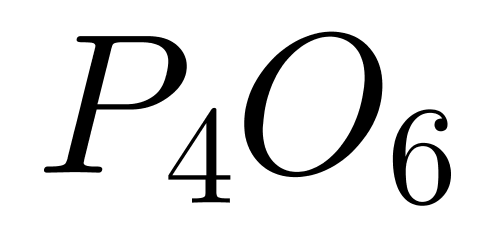
����A����Ӿ����Ƿ��Ӽ�ͨ�����Ӽ�������(���Ӽ��������������»�������������ǻ�ѧ������һ������ķ��Ӽ������������ڷ��Ӽ�������)���ɵľ��壬����еĺͣ��������������۷е�ϵͣ���˿��Խ�����������۵����;
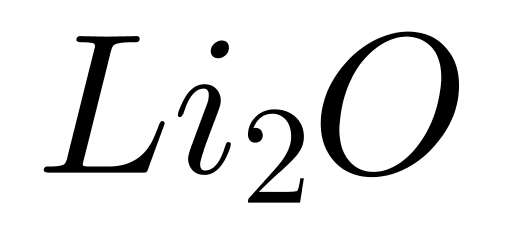
����B����Ӿ���������������ͨ�����Ӽ�����γɵľ��壬����еĺ�MgO����������ǿ���۷е�ϸߣ���˿��Խ�����������۵����;
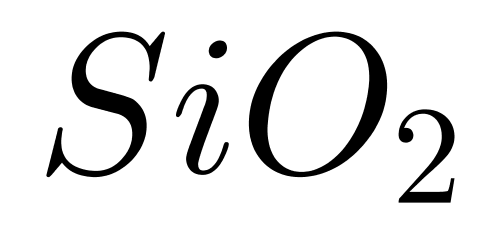
����C�ԭ�Ӿ���������ԭ��֮��ֻͨ�����ۼ���϶��ɵľ��壬����еģ���������ǿ���۷е�ϸߣ�C����������ܽ�����������۵����;
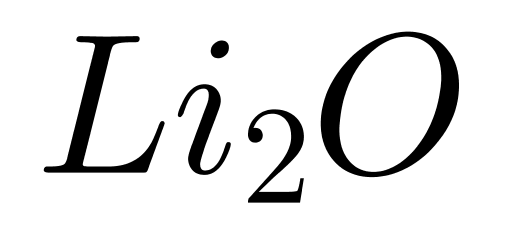
����D���MgO��Ϊ���Ӿ��壬���Ӽ����������Ϊ���Ӽ���MgO���۵�ϸߣ�����“������������Խǿ���۵�Խ��”�������Ӽ���ǿ����˿��Խ�����������۵���졣
������ˣ�ѡ��Cѡ�
���༭��zhoulin01��
